膜間領域に発現するDPPと関連エキソペプチダーゼを中心に(ref 5)
| 研究内容の紹介 |
| 1.歯周病原性細菌群の生存戦略とエキソペプチダーゼの役割 |
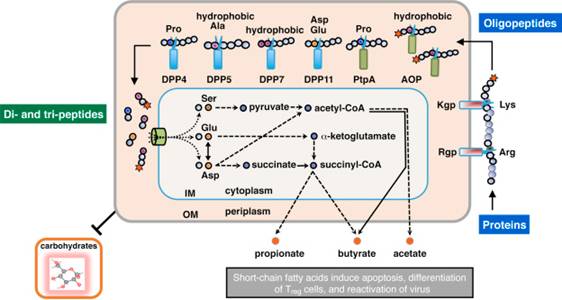
糖非発酵性グラム陰性桿菌である歯周病原性細菌Porphyromonas gingivalisが炭素源とエネルギー源としてのすべてを菌体外のタンパク性物質より得ています。このため本菌は、強力なエンドペプチダーゼであるArg-ジンジパインとLys-ジンジパインを菌体外膜及び細胞外に発現し、外来性タンパク質を速やかにオリゴペプチドに分解することができると考えられています(図1)。産生されたオリゴペプチドはさらにジペプチドやトリペプチドに変換されて内膜内に取り込んだのちにα—アミノ酸になると考えられています。この過程でジペプチドを産生する酵素がジペプチジルペプチダーセ(DPP)です。 |
|
|
| 図1 P. gingivalisのペプチド分解、取り込み、細胞内代謝経路: 膜間領域に発現するDPPと関連エキソペプチダーゼを中心に(ref 5) |
 |
| 2.分子シャペロン・ストレスタンパク質Hsp90の分子構造と作用機構 |
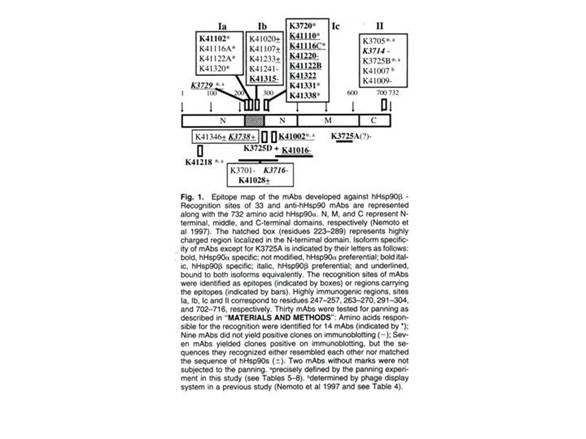
| ストレス時に誘導される細胞内タンパク質として見出されたストレスタンパク質(熱ショックタンパク質)はタンパク質の成熟から分解までを司っており,その機能から分子シャペロンと呼ばれています.1983-1984年に90 kDa熱ショックタンパク質ショック(Hsp90)が,転写活性化能を獲得する前の非活性型グルココルチコイドレセプター構成因子であることが発見されました.1990年に根本らはこのHsp90の結合がレセプターの高親和性グルココルチコイド結合に必須であり,分子シャペロンとして機能することを発見しました(1).続いて,Hsp90の分子構造とシャペロン機能の解明を目指して, Hsp90がC末側でダイマーを形成すること(2), 291-297アミノ酸に高抗原性部位が存在すること,N末ドメインとミドルドメインとの相互作用がシャペロン活性に必須であること(3),Hsp90のクライアント結合部位がアミノ酸311-350残基領域に存在すること(4)などを明らかにしました.さらに, ヒトHsp90リコンビナントタンパク質を発現し,これを抗原として 33種類のモノクローナル抗体を作成し,エピトープマッピングを行いましました.現在,これらのHsp90アイソフォーム(αおよびβ)特異的抗体は,免疫研究所やストレスゲンより市販されており,研究者に利用されています(5, 6及び図1参照) .また,Hsp90のSNPと機能についての検討から,コーカサス人に見出されるHsp90αのQ488Hのミスセンス変異がダイマー形成機能に影響を及ぼし.その結果,シャペロン機能が低下することを見いだしました(7). |
|
1. Nemoto et al., Biochemistry 29, 1880-1886, 1990 7. Kobayakawa T., et al., Protein J. 28(1), 24-28, 2009 |
| 図2 抗Hsp90モノクローナル抗体のエピトープマッピング(5) |
 |
| 3.病原因子としての細菌プロテアーゼ成熟過程と発現調節 |
| 新規のセリンプロテアーゼ遺伝子gseAを単離し(1),酵素タンパク質の分泌・成熟過程や病原性発現調節について遺伝子,タンパク質,細胞,生体レベルでの検討を行っています.表皮ブドウ球菌の日和見感染を担う病原因子と考えられるGluSEのリコンビナントタンパク質を発現しました.その結果,N末プロぺプチドが,酵素活性の抑制機能を持つこと,in vitroでサーモライシンによってプロぺプチドを切断して活性型分子に変換できること,N末プロペプチドの一部は自己消化によってプロセシングを受けることを見出しました(1).またこの研究の過程で,プロテオーム解析に汎用されている黄色ブドウ球菌由来の類縁酵素GluV8 (V8プロテアーゼ)の大腸菌発現法も確立しました(2). |
| 1. |
Ohara-Nemoto Y, et al., Y., Microb. Pathog. 33(1), 33-41, 2002 |
|
| 2. |
特許「組換えプロテアーゼの製造方法」特許第5370982号 |
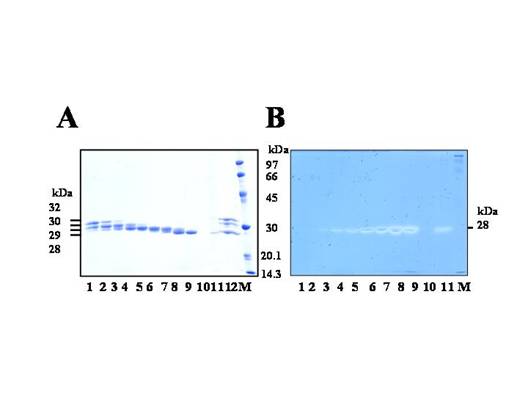
| 図3 サーモライシンによる活性化GluSE分子のSDS-PAGE
(A,クマシー染色: B,活性染色) |
 |
| 4.硬組織形成細胞の分化に影響を与える因子とその効果の解析 |
| 現在,コレステロール低下薬であるスタチン類を用いて,骨芽細胞分化への影響を検討しています.骨芽細胞への強力な分化誘導因子にはBMP2があります.スタチンはこれの合成を促して,骨分化を促進すると考えられていますが,BMP2単独の効果とは微妙に異なる部分があります.BMP2により骨芽細胞へと分化が変更されるC2C12という筋芽細胞を用いた実験では,BMP2もシンバスタチン(スタチンのひとつ)もmyotube(筋管:細胞が融合して筋繊維になるもの)の形成は阻害するものの,骨分化のマーカーであるアルカリホスファターゼの活性を上昇させるのはBMP2だけです.コレステロール代謝経路の中間代謝産物やそれらの阻害剤を用いて,スタチンの作用経路を探っています. |
| 図4 C2C12細胞へのスタチンの効果 |
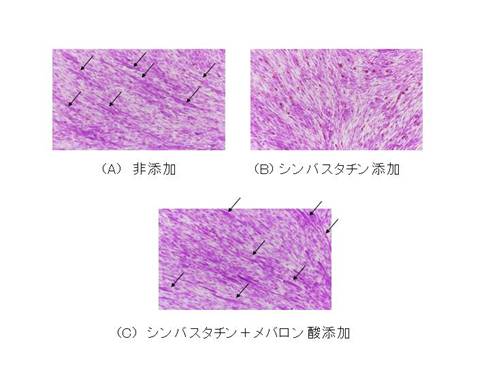 |
| C2C12のmyotube形成(A, 矢印がmyotube)はスタチン添加で全く消失したが(B),コレステロール代謝中間体であるメバロン酸を同時添加することでmyotube形成が回復した(C). |