研究内容
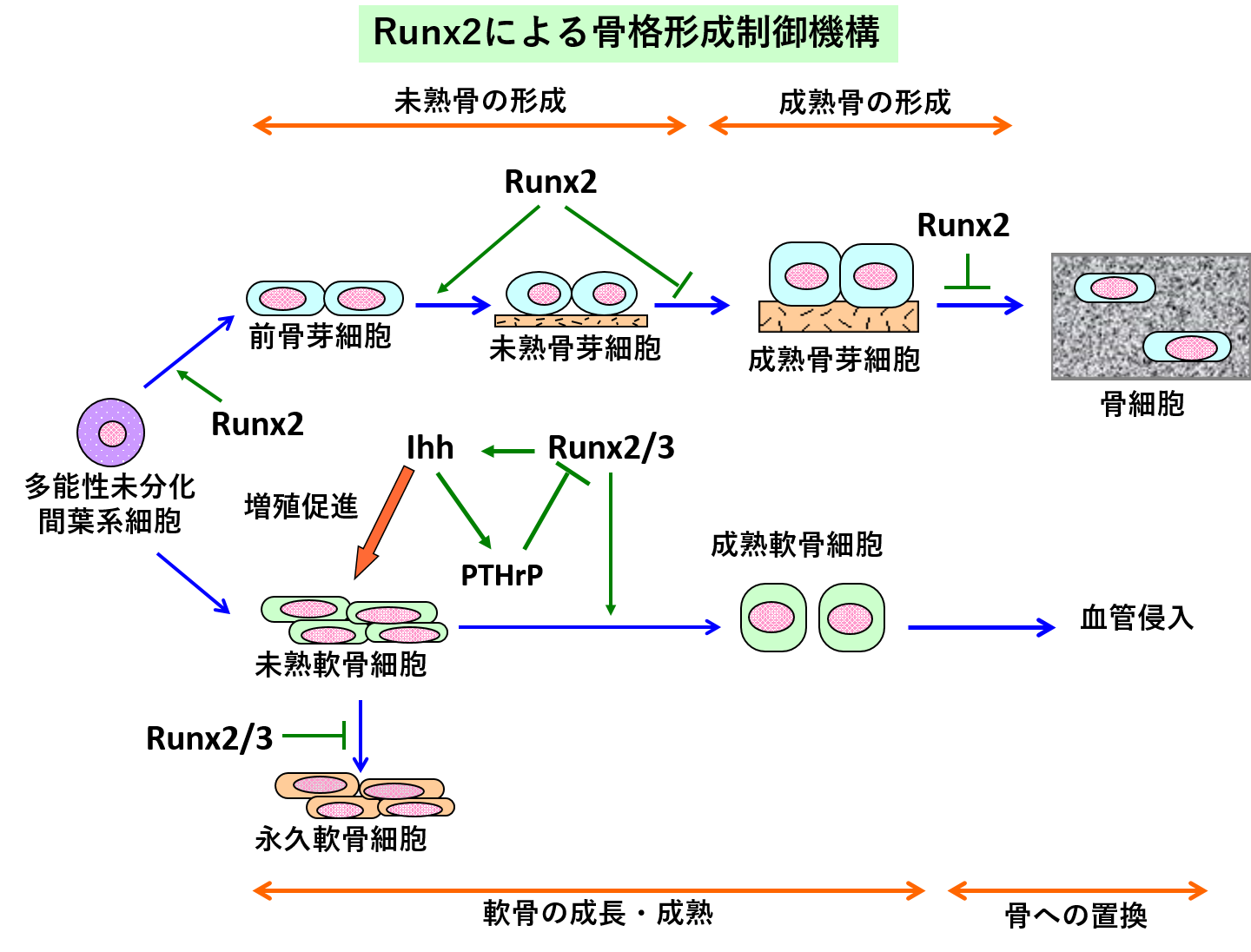
間葉系幹細胞より骨芽細胞への分化にRunx2が必須であり、Runx2は骨芽細胞の後期分化を抑制する。また、未熟軟骨細胞が成熟軟骨細胞に分化するのに、Runx2とRunx3が必須である。さらにRunx2とRunx3は、未熟軟骨細胞が永久軟骨の形質を獲得するのを阻害する。Runx2はIhhを誘導し、軟骨細胞の増殖も促進させる
Komori T. Int J Mol Sci 23: 5776, 2022.
2. 骨芽細胞前駆細胞の増殖と骨芽細胞分化機構
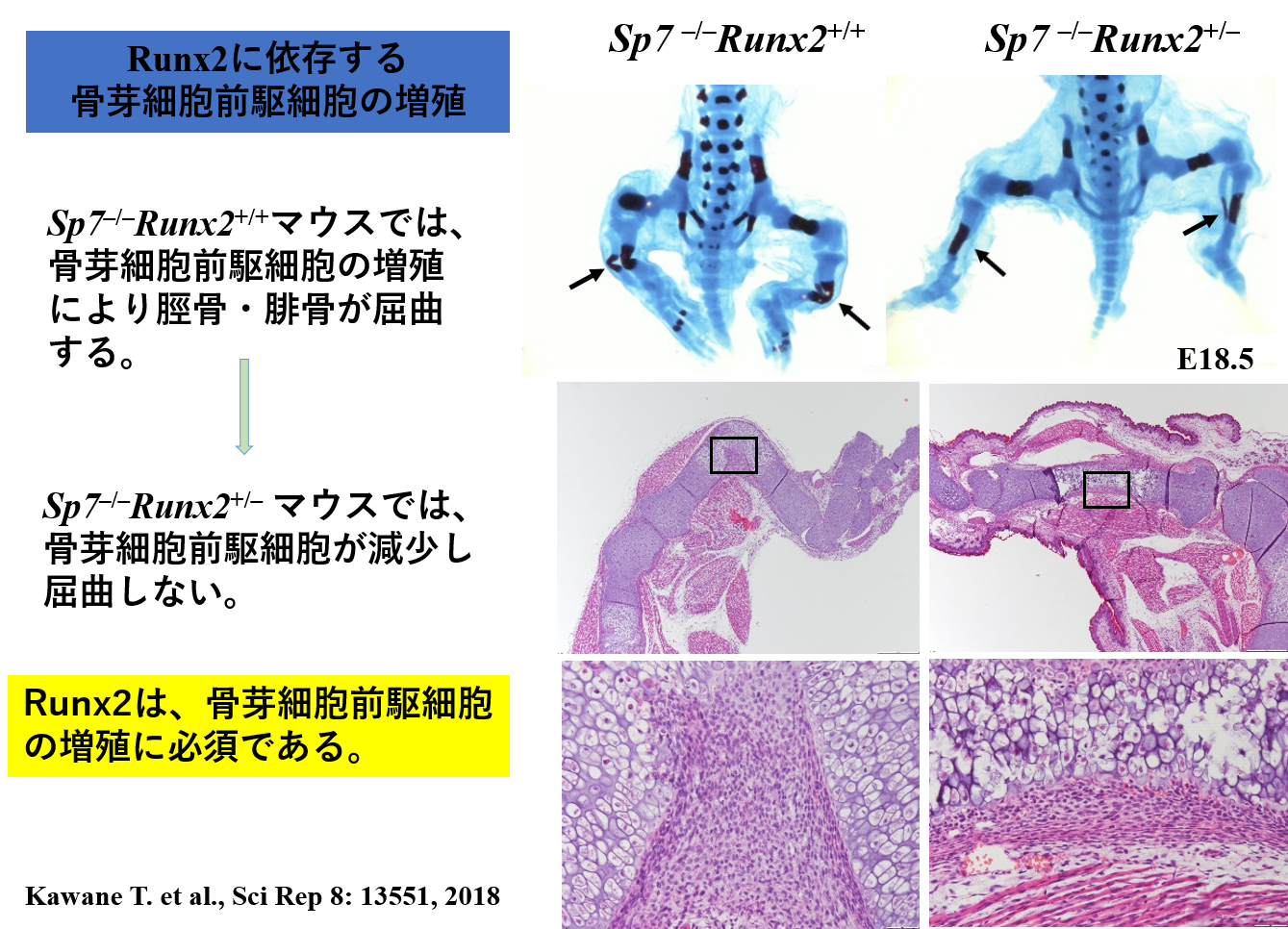
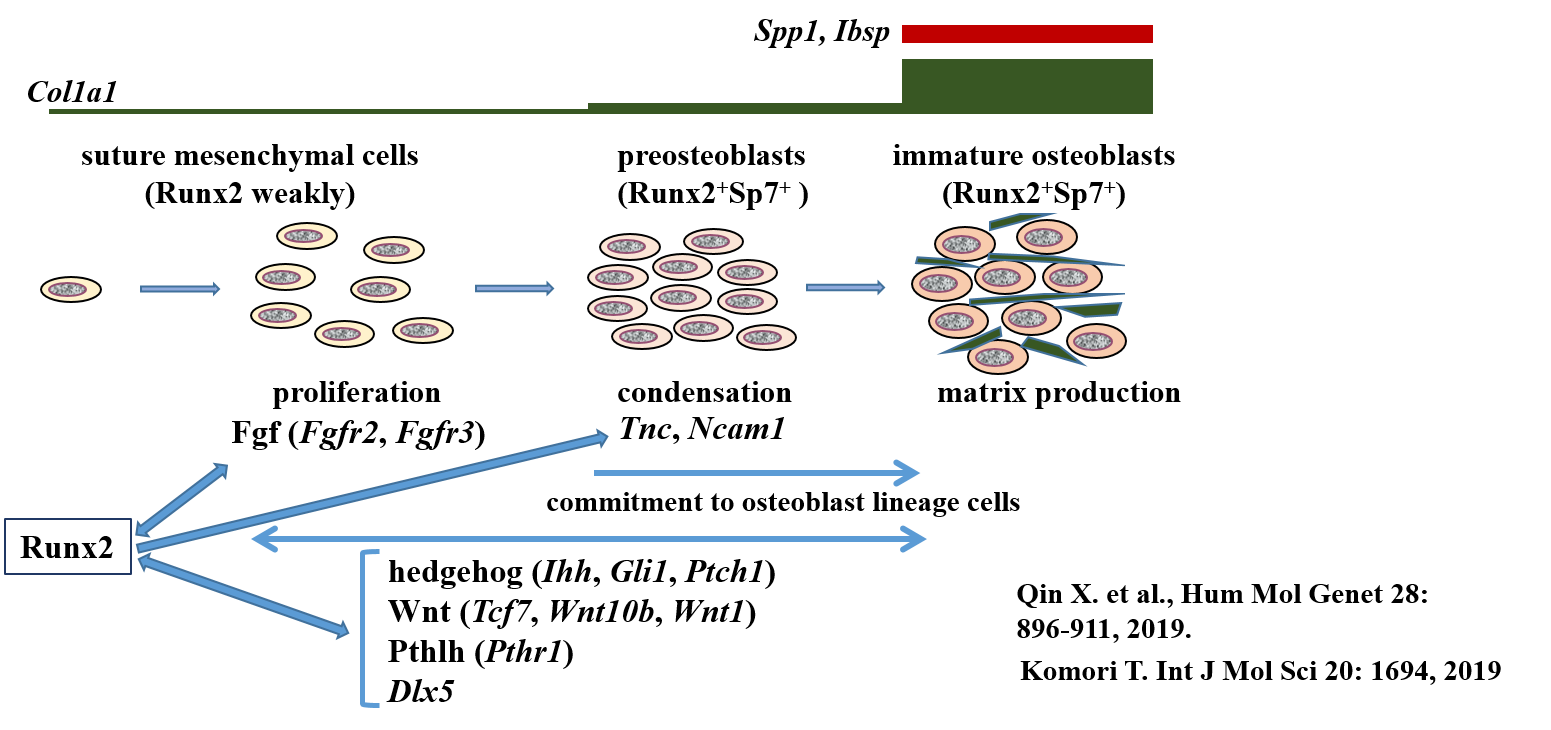
- Runx2がFgfr2, Fgfr3の発現を誘導し、骨芽細胞前駆細胞を増殖させる。一方、FGFシグナルはRunx2を活性化する。
- Runx2は転写因子Sp7の発現を誘導する。さらにhedgehog, Wntシグナルと相互作用し、骨芽細胞分化を誘導する。
- Runx2は骨芽細胞への分化誘導後、主要な骨基質タンパク質遺伝子発現を誘導する。
- Runx2は、軟骨細胞から骨芽細胞への分化転換に必須である。
- オステオカルシンは、コラーゲンに沿ってアパタイト結晶を配向させる。
Kawane T. et al., Sci Rep 8: 13551, 2018.
Komori T., Int J Mol Sci 20: 1694, 2019.
Qin X. et al., PLoS Genet 16: e1009169, 2020.
Moriishi T. et al., PLoS Genet 16: e1008586, 2020.
Qin X. et al., J Bone Miner Res 36:2081-2095, 2021.
3. 鎖骨頭蓋異形成症の縫合・泉門閉鎖不全の発症機構
4.Runx2遺伝子の転写制御機構
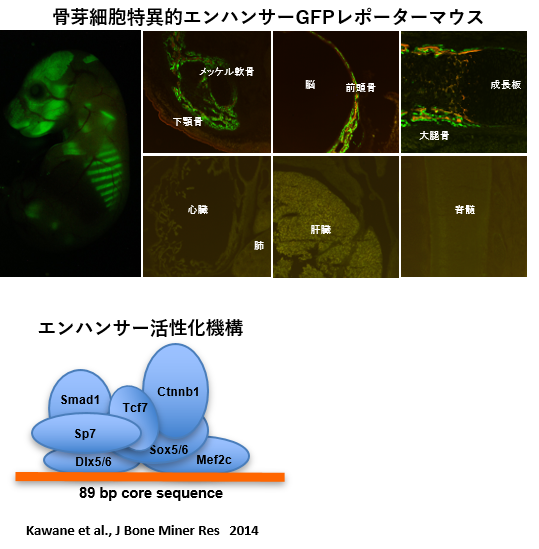
このエンハンサーにminimal promoterをつないだGFPレポーターマウスでは、骨芽細胞に特異的にGFPを発現します。軟骨細胞やその他の組織には全く発現しません。89bpの領域にこれらの転写因子が複合体を形成し、エンハンサーを活性化することを明らかにしました。
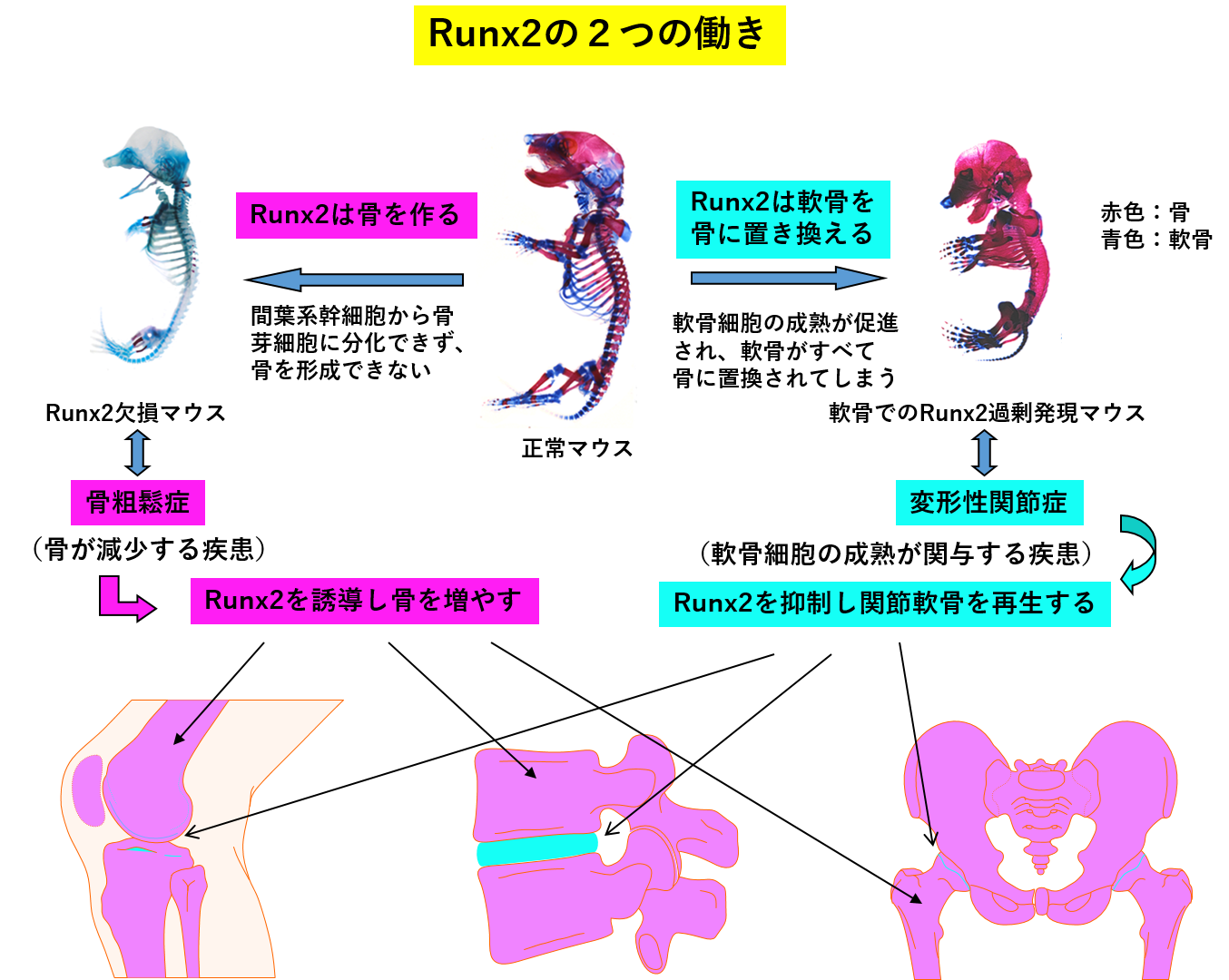
Runx2およびその下流分子は、骨芽細胞分化を誘導し、骨形成を促進させる。したがって、骨粗鬆症治療薬の有望な標的分子群である。一方、Runx2は、永久軟骨細胞ですら成熟させ、軟骨の破壊へと導き、変形性関節症の原因分子となる。したがって、Runx2あるいはその下流分子を軟骨細胞で阻害する分子は、変形性関節症治療薬の標的分子となる。
6.骨細胞による骨量制御機構の解明
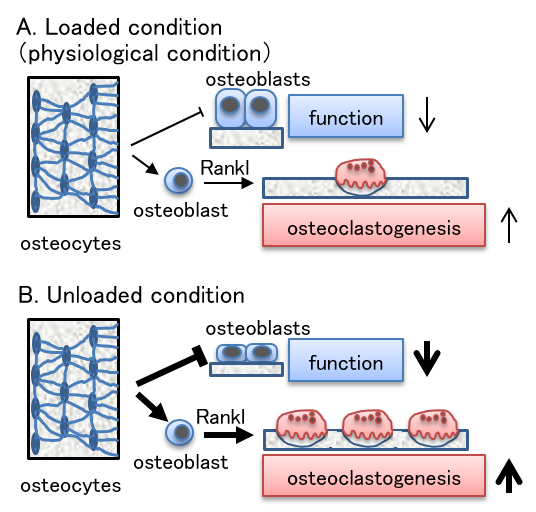
骨細胞ネットワークはメカニカルストレスを感受し骨量を調節している。すなわち、骨細胞はSost発現調節により骨芽細胞機能を制御し、骨芽細胞でのRanklの発現調節により、破骨細胞分化・活性を制御していると考えられる。通常(生理的状態)時、骨細胞ネットワークは骨芽細胞の機能を抑制し、破骨細胞分化・活性を促進している。骨細胞ネットワークは、非荷重時にはその機能を増強すると考えられる。
Moriishi T. et al., PLoS One 7: e40143, 2012.
Moriishi T. et al., Int J Mol Sci 23: 3173, 2022.
Moriishi T and Komori T. Int J Mol Sci 23: 4373, 2022.